近期,欧美口罩的认证和标准成为广大外贸出口和货代物流企业关注的焦点!最新消息显示,上周,美国疾病控制与预防中心(CDC)正式发布涉及口罩标准规定的《优化N95口罩供应策略:危机/替代策略》!
CDC宣布接受N95口罩中国标准
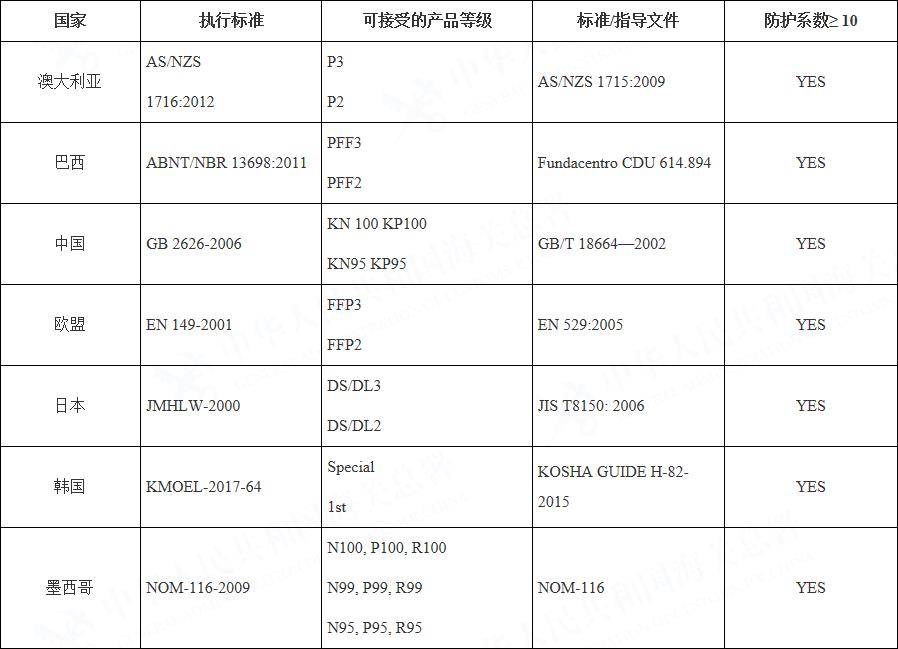
这是一个事关所有计划出口美国的外贸物流企业的事件,公告指出:新冠肺炎疫情期间,当N95口罩供给不足时,按下表中标准生产的口罩,是N95口罩合适的替代品。其中包括采用中国标准GB 2626-2006 和GB/T 18664—2002生产的口罩。



目前在疫情期间,进入美国市场都需要进口商向FDA申请获取口罩的紧急使用资质,符合以下标准的N95口罩,可以简化原美国FDA注册流程以及NIOSH的检测流程,快速投入使用。

早前,美国副总统彭斯在3月5日新闻发布会上告诉大家,“除非病了,否则无需购买口罩”。

这真是啪啪的打脸,但也给国内口罩生产商和贸易企业创造了出口机会,而且美国也已取消口罩等部分防疫产品的关税加征。
欧盟开启口罩绿色通道
不仅美国,同样深陷新冠肺炎疫情的欧洲,同样特事特办,紧急开通了口罩类防疫物资的绿色通道。
近日,欧美紧急放宽口罩等防疫物资准入要求(CE认证和FDA认证),需要机构认证的产品在完成合规性评估程序之前(即取得CE/FDA标志之前)可以先出口,但是要确保认证工作会继续完成。
欧盟成员国主管当局可在疫情期间评估和集中采购没有CE标记的防疫产品,该产品仅可以提供给医护人员使用,不能在市场上流通销售。如果你的产品不是政府集中采购,且要在当地市场上销售的,则不属于上述放宽准入的条件范围。
2020年3月13日,欧盟会员会在欧洲官方杂志( Official Journal of the EuropeanUnion)发布了疫情期间针对医疗器械和个人防护用品 (PPE)的符合性评价和市场监督程序的建议。
医疗器械方面:
◆如果市场监督机构确定产品符合医疗器械的基本安全和性能要求,即使其符合性评价还未完成,市场监督机构可以允许其在一定的时间内进行销售,同时该产品必须继续完成其符合性评价过程。
◆成员国主管当局也可在疫情期间评估和组织采购没有CE标记的医疗器械,该产品仅可提供给医疗工作者使用,不能在市场上流通销售。同时市场抽查将会重点抽查防疫相关医疗器械,以防止不合格产品导致严重风险。
个人防护用品(PPE)方面:
◆涉及的产品包括抛弃式和可重复使用的口罩、可重复使用的工作服、手套和眼罩等(主要是预防病毒和有害物质的产品)。需要具有PPE法规授权资格的公告机构进行符合性评价。
◆应急审批产品如果不采用PPE法规协调标准作为产品技术要求而采用其它技术要求,比如WHO的推荐要求,须确保采用的技术要求与PPE法规基本健康与安全要求同等防护水平。公告机构对这类采用其它技术要求的PPE产品进行发证时,需要立即通知主管当局和其它PPE法规的公告机构。
◆ if the emergency approved products do not adopt the coordinated standards of PPE regulations as the product technical requirements, but adopt other technical requirements, such as the recommended requirements of who, it must ensure that the adopted technical requirements have the same protection level as the basic health and safety requirements of PPE regulations. When issuing certificates for such PPE products with other technical requirements, the notified body shall immediately notify the competent authority and the notified body of other PPE regulations.
◆如果市场监督机构确定产品符合PPE法规的基本健康和安全要求,即使其符合性评价还未完成,市场监督机构可以允许其在一定的时间内进行销售,同时该产品必须继续完成其符合性评价过程。
◆成员国主管当局也可在疫情期间评估和组织采购没有CE标记的PPE产品,该产品仅可提供给医疗工作者使用,不能在市场上流通销售。同时市场抽查将会重点抽查防疫相关PPE产品,以防止不合格产品导致严重风险。
也就是说,只要处于正在进行符合性评估的过程中,就可以在没有CE标志的情况下先行进入欧盟市场。由市场监督部门进行抽查,发现问题再进行处罚。
重点如下!!!
◆成员国可采购安全有效,但没有CE标记的医疗产品;
◆紧急物资专供医疗人员使用,不可在市场上流通;
◆仅疫情期间有效。
关于CE标识
CE标签就像一把巨伞,底下是规定各类产品安全标准、细分到不同材料和生产模式等的各种欧盟指令。自1985年成立以来,它就成为了高质量、高标准和严格执法的标志,缺少这一标志的商品将不予获准进入欧盟市场。
如今CE标识已经成为了全球认可的质量标志,CE标志可以证明该批在欧盟制作或进口至欧盟成员国的产品符合质量标准,满足保护消费者健康、供应链安全和环境可持续发展的要求。
欧盟口罩要求
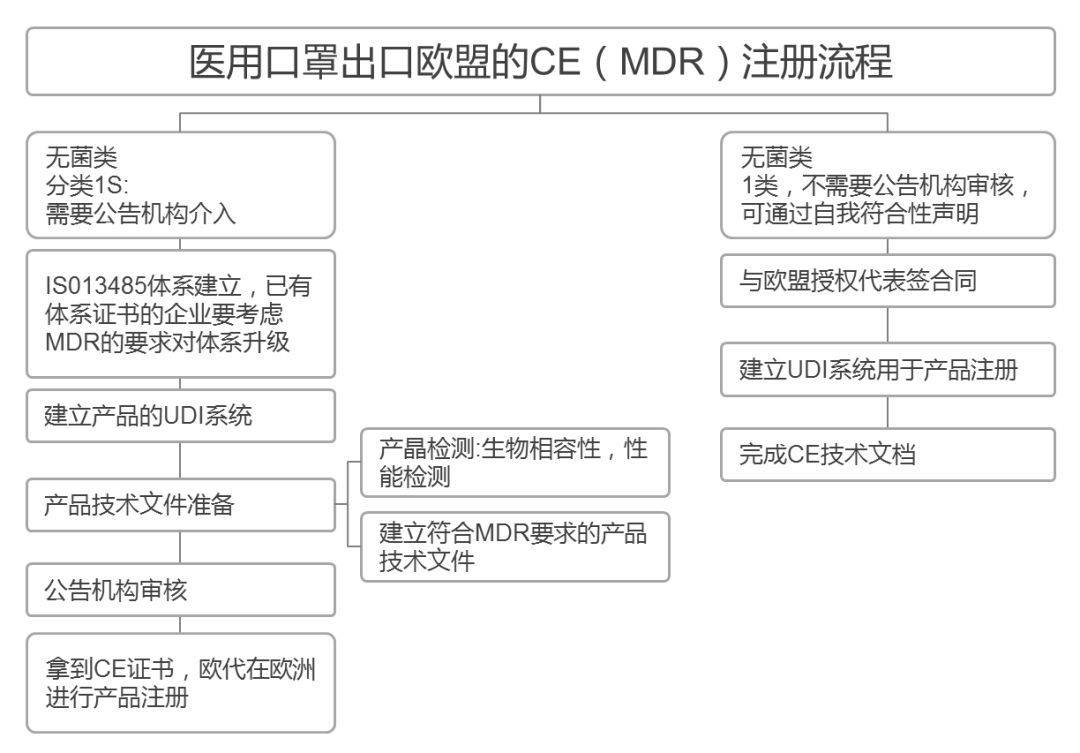
在欧盟,口罩属于PPE个人防护用品,“危及健康的物质和混合物”。2019年起,欧盟新法规PPE Regulation (EU) 2016/425强制执行,所有出口欧盟的口罩必须在新法规的要求下获得CE认证证书。CE认证证书的有效期是5年左右,一般费用是10000-15000元人民币。
欧盟对于口罩欧洲统一,CE认证的标准包括BSEN140、BSEN14387、BSEN143、BSEN149、BSEN136,其中BSEN149使用多,为可防护微粒的过滤式半口罩,根据测试的粒子穿透率分为P1(FFP1),P2(FFP2),P3(FFP3)三个等级,FFP1低过滤效果≥80%,FFP2低过滤效果≥94%,FFP3低过滤效果≥97%。
FFP2口罩与上文提到的医用防护口罩、KN95口罩、N95口罩过滤效率十分接近。医疗口罩必须遵循BSEN14683标准,可以分为三个等级:低标准Type、然后是Type和TypeR。上一个版本是BSEN146832014,已被新版BSEN146832019所取代。EN 14683:2019年版主要的变化之一是压力差,Type、Type、TypeR压力差分别由2014年版的29.4、29.4、49.0Pa/cm,上升至40、40、60Pa/cm。
CE认证是欧盟实行的强制性产品安全认证制度,目的是为了保障欧盟国家人民的生命财产安全。

新手小白可以问自己的发证机构两个问题:
01、贵司是否为NB机构? 机构号是否可以查询?
NB机构可以理解为被欧盟授权或认可的机构。如果CE证书是NB机构发证的,在欧盟就具有一定的效应,清关的风险才会相对较小。
一般情况下,根据欧盟法规,出口欧盟的所有产品都需要通过CE认证,贴上CE标志才能进入欧洲市场。欧盟公布了一系列由欧盟统一监管和认证资质授权的机构,并授予每个机构唯一的四位数代码,即公告号。CE证书的申请和颁发由相应法规和指令授权的公告号机构颁发。
02、出具的CE证书在官网可查吗?
在欧盟官方网站-欧盟公告机构查询官网,厂家可以查询到目前从0001-2786 两千多家欧盟公告号机构详细信息,每家机构对应的指令和法规授权以及发证机构信息都可在该网站查询到。
附:CE认证查验:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=notifiedbody.main
附:FDA查验(出口美国需要FDA和NIOSH):
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm
COVID-19威胁范围内的合格评定和市场监督程序
欧洲委员会,考虑到《欧洲联盟运作条约》,特别是其第292条,鉴于:






通过了此建议:
1.为了确保在COVID-19爆发中提供个人防护设备和医疗设备以提供适当的保护,委员会邀请整个供应链中的所有经济运营商以及指定机构和市场监督机构在其部署中采取所有措施处置以支持旨在确保整个欧盟市场的个人防护设备和医疗设备的供应与不断增长的需求相匹配的工作。但是,此类措施不应对整体健康和安全水平产生不利影响,所有相关利益相关方应确保投放到欧盟市场的任何个人防护设备或医疗设备继续为用户提供足够的保护水平' 健康和安全。
合格评定程序
2、根据(EU)2016/425号条例的指定机构,应优先考虑并迅速进行PPE经济运营商在保护COVID-19时应保护的PPE经济运营商所有新提交的要求中的合格评定活动。
3.对于遵循非统一标准技术解决方案生产的PPE产品,只要这些技术解决方案保证足够的保护水平,WHO建议适当选择PPE作为这类技术解决方案的潜在参考来源。符合法律法规(EU)2016/425规定的基本健康和安全要求。
4.对于按照统一标准以外的其他技术解决方案生产的PPE产品发行证明书的认证机构,必须立即发行证明书和遵循的具体技术解决方案通知相关的通报机构和根据(EU)2016/425条的其他认证机构。公告机构应当通过法规(EU)2016/425第36条设立的公告机构小组的协调交换此类信息。
5,就医疗器械而言,根据指令93/42 / EEC第11(13)条和法规(EU)2017/745的第59条,还应考虑成员国授权从合格评定程序中减损的可能性。后者在不需要指定机构介入的情况下也适用。
市场监督程序
6、成员国的相关市场监督机构应优先关注不合规的个人防护设备或医疗设备,这些设备会对其预期用户的健康和安全造成严重风险。
7、市场监督机构发现PPE或医疗设备可确保根据(EU)2016/425法规或93/42 / EEC指令或2017(EU)法规的基本要求确保足够的健康和安全水平/ 745,即使尚未按照协调规则完全完成包括CE标志在内的合格评定程序,它们仍可以授权在限定的时间内在欧盟市场上提供这些产品程序正在执行中。
7. The market surveillance agency found that PPE or medical equipment can ensure sufficient health and safety level / 745 in accordance with the basic requirements of (EU) Regulation 2016 / 425 or directive 93 / 42 / EEC or regulation 2017 (EU), even if the conformity assessment procedure including CE mark has not been fully completed in accordance with the coordination rules, They can still authorize the availability of these products on the EU market for a limited time, and the program is being implemented.
8、不带CE标志的PPE或医疗设备也可以进行评估,并由相关成员国当局组织购买的一部分,前提是要确保此类产品仅在当前健康危机期间可供医护人员使用,并确保它们没有进入常规分销渠道,并可供其他用户使用。
9、市场监督机构应立即将其授予特定PPE或医疗设备的任何临时安排告知委员会和其他成员国。对于个人防护设备,应通过用于市场监视的信息和通信系统(ICSMS)来完成。
欧盟成员国名单(27国):
奥地利、比利时、保加利亚、塞浦路斯、捷克、克罗地亚、丹麦、爱沙尼亚、芬兰、法国、德国、希腊、匈牙利、爱尔兰、意大利、拉脱维亚、罗马尼亚、立陶宛、卢森堡、马耳他、荷兰、波兰、葡萄牙、斯洛伐克、斯洛文尼亚、西班牙、瑞典。
